ทฤษฎีกรด
- เบส |
ทฤษฎีกรด-
เบสของอาร์เรเนียส
| ข้อจำกัดของทฤษฎีกรด
- เบส อาร์เรเนียส
ทฤษฎีกรด-
เบส ของเบรินสเตต-
เลารี | ข้อจำกัดของทฤษฎีกรด
- เบสของเบรินสเตต-
ลาวรี
สารที่เป็นได้ทั้งกรดและเบส
| ทฤษฎีกรด-
เบสของลิวอีส
ทฤษฎีกรด
- เบส
ในการที่จะให้นิยามของกรด-
เบส และในการจำแนกสารต่างๆ
ว่าเป็นกรดหรือเบสนั้นได้มีนักวิทยาศาสตร์
ได้ศึกษาและตั้งทฤษฎีกรด-
เบส ขึ้นหลายทฤษฎีด้วยกัน
ทฤษฎีกรด- เบสที่สำคัญมีดังนี้
::กลับด้านบน::
ทฤษฎีกรด-
เบสของอาร์เรเนียส
อาร์เรเนียส
เป็นนักวิทยาศาสตร์ชาวสวีเดน
ได้ตั้งทฤษฎีกรด-
เบส ในปี ค. ศ.
1887 ( พ. ศ. 2430) อาร์เรเนียสศึกษาสารที่ละลายน้ำ
(Aqueous solution) และการนำไฟฟ้าของสารละลายนั้น
เขาพบว่าสารอิเล็กโทรไลต์จะแตกตัวเป็นไอออน
เมื่อละลายอยู่ในน้ำและให้นิยามกรดไว้ว่า
“ กรด คือ
สารที่เมื่อละลายน้ำแล้วแตกตัวให้ไฮโดรเจนไอออน”
เช่น
HCl (g) 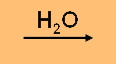 H+
(aq) + Cl- (aq) H+
(aq) + Cl- (aq)
HClO4(l) 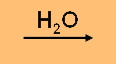 H+ (aq) + ClO4- (aq)
H+ (aq) + ClO4- (aq)
CH3COOH (l) 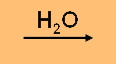 H+ (aq) + CH3COO- (aq)
H+ (aq) + CH3COO- (aq)
H2SO4 (l) 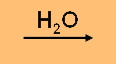 H+ (aq) + SO22-(aq)
H+ (aq) + SO22-(aq)
H2CO3 (l) 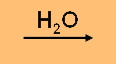 H+ (aq) + HCO3- (aq)
H+ (aq) + HCO3- (aq)
“ เบสคือ
สารที่เมื่อละลายน้ำแล้วแตกตัวให้ไฮดรอกไซด์ไอออน”
เช่น
NaOH (s) 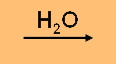 Na+
(aq) + OH- (aq) Na+
(aq) + OH- (aq)
Ca(OH)2 (s) 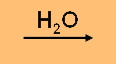 Ca2+ (aq) + 2OH- (aq)
Ca2+ (aq) + 2OH- (aq)
KOH (s) 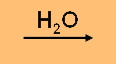 K+
(aq) + OH- (aq) K+
(aq) + OH- (aq)
NH4OH (l) 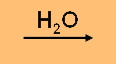 NH4+ (aq) + OH- (aq)
NH4+ (aq) + OH- (aq)
::กลับด้านบน::
ข้อจำกัดของทฤษฎีกรด
- เบส อาร์เรเนียส
- ทฤษฎีกรด-
เบส อาร์เรเนียส
จะเน้นเฉพาะการแตกตัวในน้ำ
ให้เป็น H+
และ OH- ไม่รวมถึงตัวทำละลายอื่นๆ
ทำให้อธิบายความเป็นกรด-
เบสได้จำกัด
- สารที่ี่จะเป็นกรดได้ต้องมี
H+ อยู่ในโมเลกุล
และสารที่ี่จะเป็นเบสได้ก็ต้องมี
OH- อยู่ในโมเลกุล
::กลับด้านบน::
ทฤษฎีกรด-
เบส ของเบรินสเตต-
เลารี
โจฮันส์
นิโคลัส เบรินสเตต
นักเคมีชาวเดนมาร์ก
และ โทมัส มาร์ติน
ลาวรี นักเคมีชาวอังกฤษ
ได้ศึกษาการให้และรับโปรตอนของสาร
เพื่อใช้ในการอธิบายและจำแนกกรด-
เบสได้กว้างขึ้น
และได้ตั้งทฤษฎีกรด-
เบสขึ้นในปี
ค. ศ.1923 ( พ. ศ.2466)
กรด
คือ สารที่ี่สามารถให้โปรตอนกับสารอื่นๆ
ได้ (Proton donor)
เบส
คือ สารที่ี่สามารถรับโปรตอนจากสารอื่นได้
(Proton acceptor)
พิจารณาตัวอย่างต่อไปนี้
1.
HCl เป็นสารที่ี่ให้โปรตอน
(H+) ดังนั้น HCl จึงเป็นกรด
H2O เป็นสารที่ี่รับโปรตอน
(H+) ดังนั้น H2Oจึงเป็นเบส
2.
NH4+ เป็นสารที่ี่ให้โปรตอน
(H+) ดังนั้น NH4+จึงเป็นกรด
H2Oเป็นสารที่ี่รับโปรตอน
(H+) ดังนั้น H2Oจึงเป็นเบส
3.
H2Oเป็นสารที่ี่ให้โปรตอน
(H+) ดังนั้น H2Oจึงเป็นกรด
NH3เป็นสารที่ี่รับโปรตอน
(H+) ดังนั้น NH3 จึงเป็นเบส
จากปฏิกิริยาทั้ง
3 ปฏิกิริยา
จะมีสารที่ี่ให้และรับโปรตอนในแต่ละปฏิกิริยา
และมี H3O+
และ OH- เกิดขึ้น
::กลับด้านบน::
ข้อจำกัดของทฤษฎีกรด
- เบสของเบรินสเตต-
ลาวรี
ทฤษฎีกรด- เบสของเบรินสเตต-
ลาวรี ใช้อธิบายสมบัติของกรด-
เบส ได้กว้างกว่าทฤษฎีของอาร์เรเนียส
แต่ยังมีข้อจำกัดคือ
สารที่จะทำหน้าที่เป็นกรดจะต้องมีโปรตอนอยู่ในสารนั้น
::กลับด้านบน::
สารที่เป็นได้ทั้งกรดและเบส
(Amphoteric)
สารบางตัวทำหน้าที่เป็นทั้งกรด
เมื่อทำปฏิกิริยากับสารตัวหนึ่ง
และทำหน้าที่เป็นเบส
เมื่อทำปฏิกิริยากับอีกสารหนึ่ง
นั่นคือเป็นได้ทั้งกรดและเบส
สารที่มีลักษณะนี้เรียกว่า
สารเอมโพเทอริก(Amphoteric)
เช่น H2O , HCO3-
เป็นต้น
กรณีของ H2O
ในกรณีนี้
H2O เป็นกรดเมื่อทำปฏิกิริยากับ
NH3 และเป็นเบสเมื่อทำปฏิกิริยากับNH4+
กรณีของ HCO3-
ในกรณีนี้
HCO3- เป็นเบสเมื่อทำปฏิกิริยากับ
HCl และเป็นกรดเมื่อทำปฏิกิริยากับ
OH-
ดังนั้นอาจจะสรุปได้ว่า
สารที่เป็นเอมโฟเทอริก
ถ้าทำปฏิกิริยากับสารที่ให้โปรตอนได้ดีกว่า
ตัวมันเองจะรับโปรตอน
( ทำหน้าที่เป็นเบส)
แต่ถ้าไปทำปฏิกิริยากับสารที่ให้โปรตอนได้ไม่ดี
ตัวมันเองจะเป็นตัวให้โปรตอนกับสารนั้น
( ทำหน้าเป็นกรด)
::กลับด้านบน::
ทฤษฎีกรด-
เบสของลิวอีส
ในปี ค. ศ. 1923 ( พ.
ศ. 2466) ลิวอีสไดเสนอนิยามของกรดและเบสดังนี้
กรด คือ
สารที่สามารถรับอิเล็กตรอนคู่
จากเบส แล้วเกิดพันธะโคเวเลนต์
เบส คือ
สารที่สามารถให้อิเล็กตรอนคู่ในการเกิดพันธะโคเวเลนต์
ปฏิกิริยาระหว่างกรด-
เบส ตามทฤษฎีนี้
อธิบายในเทอมที่มีการใช้อิเล็กตรอนคู่ร่วมกัน
กรดรับอิเล็กตรอนเรียกว่าเป็น
Electrophile และเบสให้อิเล็กตรอนเรียกว่าเป็น
Nucleophile และตามทฤษฎีนี้สารที่เป็นเบสต้องมีอิเล็กตรอนคู่อิสระ
เช่น
ในกรณีนี้
NH3 เป็นเบส
มีอิเล็กตรอนคู่
1 คู่ จะให้อิเล็กตรอนคู่กับกรดในการเกิดพันธะโคเวเลนต์
และ BF3รับอิเล็กตรอนจาก
NH3BF3 จึงเป็นกรด
ทฤษฎีของลิวอิสนี้มีข้อดีคือ
สามารถจำแนกกรด-
เบส ที่ไม่มีทั้ง
H หรือ OH- ในสารนั้น
และแม้ว่าสารนั้นไม่ได้อยู่ในรูปสารละลาย
แต่อยู่ในสถานะแก๊สก็สามารถใช้ทฤษฎีลิวอิสอธิบายความเป็นกรดเบสได้
ตัวอย่างอื่นๆ
เช่น
ตัวอย่างที่
4 ปฏิกิริยาต่อไปนี้
สารตั้งต้นใดทำหน้าที่เป็นกรด
สารใดทำหน้าที่เป็นเบสตามทฤษฎีของอาร์เรเนียส
ก. HSO4- (aq) + H2O (l)
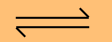 SO4
2- + H3O + H2O SO4
2- + H3O + H2O
ข. LiOH (s) 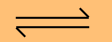 Li2+ + OH-
Li2+ + OH-
ค. H2O + H2O 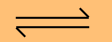 H3O + + OH-
H3O + + OH-
วิธีทำ
ก. HSO4- (aq) + H2O (l)
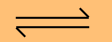 SO4
2- + H3O+ SO4
2- + H3O+
HSO4- ให้ H+
ในน้ำ HSO4--
ทำหน้าที่เป็นกรด
ข. LiOH (s) เป็นเบสเพราะ
แตกตัวให้
OH- ในน้ำ
ค. H2Oเป็นทั้งกรดและเบส
โมเลกุลหนึ่งให้
H3O+ ( เป็นกรด)
อีกโมเลกุลหนึ่งแตกตัวให้
OH- ( เป็นเบส)
ตัวอย่างที่
5 ในปฏิกิริยาต่อไปนี้
HCO3- ไอออนทำหน้าที่เป็นกรดในปฏิกิริยาใด
ก. HCO3- (aq) + H2O (l)
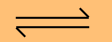 H2CO3
(aq) + OH- (aq) H2CO3
(aq) + OH- (aq)
ข. HCO3- (aq) + OH- (aq)
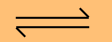 H2O
(l) + CO3 2- (aq) H2O
(l) + CO3 2- (aq)
ค. HCO3- (aq) + HSO4
- (aq) 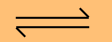 H2CO3 (aq) + SO 4 2-
(aq)
H2CO3 (aq) + SO 4 2-
(aq)
ง. HCO3- (aq) + CH3COOH
(aq)  H2O
(l) + CO2 (g) + CH3COO- (aq) H2O
(l) + CO2 (g) + CH3COO- (aq)
วิธีทำ
ก. HCO3- (aq) ไม่ใช่กรด
แต่เป็นเบสเพราะรับ
H+
ข. HCO3- (aq) เป็นกรด
เพราะให้ H+
กับ OH-
ค. HCO3- (aq) เป็นเบส
เพราะรับ H+
ง. HCO3- (aq) เป็นเบส
เพราะรับH+จาก
CH3COOH (aq) ได้ H2O (l)
+ CO2(g)
ตัวอย่างที่
6 สารต่อไปนี้
ข้อใดทำหน้าที่ได้ทั้งกรดและเบส
ก. HC2O4 2-
ข. CO3 2-
ค. CN -
ง. HSO4 -
เฉลย
ข้อ ก และ ง
เป็นได้ทั้งกรดและเบส
เพราะสามารถให้
และรับ H+ ได้
ข้อ ข และ ค.
เป็นเบสได้เพียงอย่างเดียว
เพราะให้โปรตอนไม่ได้เนื่องจากไม่มี
H แต่สามารถรับโปรตอนได้
กลายเป็น HCO3-
และ HCN ตามลำดับ
::กลับด้านบน::
|